 Seperti
diketahui bahwa temperatur merupakan salah satu properti sistem yang
telah dikenal luas penggunaannya, akan tetapi agak sukar untuk
mendefinisikannya, oleh karenanya definisi tentang temperatur akan lebih
baik diberikan dalam suatu fenomena saja. pertama kita menyadari adanya
temperatur (suhu) sebagai perasaan panas atau dingin bila kita
menyentuh suatu benda. Demikian juga apabila dua buah benda, yang satu
panas dan yang satu dingin, disentuhkan satu sama lain, maka benda yang
panas akan mendingin, dan yang dingin akan menjadi panas, sehingga pada
suatu waktu, keduanya akan memiliki rasa panas atau dingin yang sama.
Sebenarnya yang terjadi adalah kedua benda tersebut mengalami perubahan
sifat, dan pada waktu proses perubahan ini berhenti, kedua benda berada
dalam keadaan kesetimbangan thermal. Jadi dua sistem yang berada dalam
kesetimbangan thermal mempunyai sifat yang sama, sifat ini disebut
temperatur (suhu). Dengan
kata lain, temperatur dari suatu benda adalah suatu indikator dari
keadaan panas yang dimiliki-nya didasari kepada kemampuan benda tersebut
untuk mentransfer panas ke benda lain. Hukum dasar yang mendasari
pengukuran suhu dikenal dengan hukum thermodinamika ke-nol.
Hukum thermodinamika ke-nol menyatakan bahwa apabila dua buah benda
masing-masing berada dalam keadaan kesetimbangan thermal dengan benda
yang ketiga, maka kedua benda ini berada dalam kesetimbangan termal satu
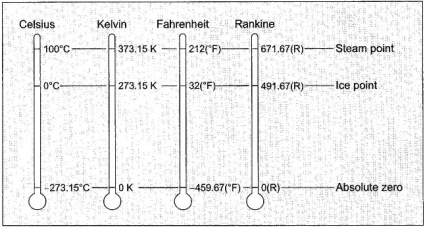
sama lain, artinya, suhu kedua benda tersebut adalah sama. Skala untuk
menentukan besar kecilnya temperatur yang sudah dikenal adalah
Fahrenheit, Celcius, Kelvin dan Rankine. Untuk melihat perbedaan skala
dari ke empat skala tersebut, bisa dilihat pada gambar berikut ini
Seperti
diketahui bahwa temperatur merupakan salah satu properti sistem yang
telah dikenal luas penggunaannya, akan tetapi agak sukar untuk
mendefinisikannya, oleh karenanya definisi tentang temperatur akan lebih
baik diberikan dalam suatu fenomena saja. pertama kita menyadari adanya
temperatur (suhu) sebagai perasaan panas atau dingin bila kita
menyentuh suatu benda. Demikian juga apabila dua buah benda, yang satu
panas dan yang satu dingin, disentuhkan satu sama lain, maka benda yang
panas akan mendingin, dan yang dingin akan menjadi panas, sehingga pada
suatu waktu, keduanya akan memiliki rasa panas atau dingin yang sama.
Sebenarnya yang terjadi adalah kedua benda tersebut mengalami perubahan
sifat, dan pada waktu proses perubahan ini berhenti, kedua benda berada
dalam keadaan kesetimbangan thermal. Jadi dua sistem yang berada dalam
kesetimbangan thermal mempunyai sifat yang sama, sifat ini disebut
temperatur (suhu). Dengan
kata lain, temperatur dari suatu benda adalah suatu indikator dari
keadaan panas yang dimiliki-nya didasari kepada kemampuan benda tersebut
untuk mentransfer panas ke benda lain. Hukum dasar yang mendasari
pengukuran suhu dikenal dengan hukum thermodinamika ke-nol.
Hukum thermodinamika ke-nol menyatakan bahwa apabila dua buah benda
masing-masing berada dalam keadaan kesetimbangan thermal dengan benda
yang ketiga, maka kedua benda ini berada dalam kesetimbangan termal satu
sama lain, artinya, suhu kedua benda tersebut adalah sama. Skala untuk
menentukan besar kecilnya temperatur yang sudah dikenal adalah
Fahrenheit, Celcius, Kelvin dan Rankine. Untuk melihat perbedaan skala
dari ke empat skala tersebut, bisa dilihat pada gambar berikut ini .
Gambar 1. Skema Perbandingan Temperatur
Jelas
terlihat bahwa satu satuan derajat (satuan perbedaan temperatur) adalah
tidak sama untuk Kelvin-Celcius dengan Rankine-Fahrenheit, atau dengan
kata lain bisa di buat :
dan dari nilai skala seperti pada Gambar 1, diperoleh perbandingan :
dari
penjelasan tersebut, maka dapat diperoleh relasi antara Rankine dengan
Fahrenheit dan relasi antara Celcius dengan Kelvin seperti berikut ini.
2. Tekanan
Tekanan secara matematis dapat diefinisikan seperti berikut ini :
P=Fn/A (6)
Fn = Komponen Gaya Normal tegak lurus A
A = Luas penampang Lintang
Agar lebih mudah dipahami, perhatikan Gambar 2 berikut ini.
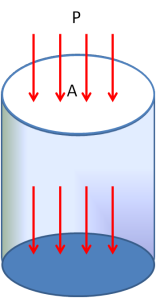 Untuk
gas dan cairan, istilah tekanan sering digunakan, tetapi untuk zat
padat, lebih sering digunakan istilah tegangan. Tekanan pada tiap titik
dalam fluida yang diam besarnya sama ke segala arah dan tekanan
didefinisikan sebagai komponen gaya yang tegak lurus pada suatu bidang
per satuan luas. Tekanan P pada suatu titik di dalam fluida yang berada
dalam kesetimbangan besarnya sama ke segala arah, akan tetapi untuk zat
cair yang pekat dan dalam keadaan bergerak, variasi tekanan terhadap
kedudukan bidang datumnya merupakan suatu hal yang penting dan perlu
pembahasan khusus di luar thermodinamika. Dalam thermodinamika klasik,
umumnya diperhatikan tekanan fluida dalam keadaan setimbang.
Untuk
gas dan cairan, istilah tekanan sering digunakan, tetapi untuk zat
padat, lebih sering digunakan istilah tegangan. Tekanan pada tiap titik
dalam fluida yang diam besarnya sama ke segala arah dan tekanan
didefinisikan sebagai komponen gaya yang tegak lurus pada suatu bidang
per satuan luas. Tekanan P pada suatu titik di dalam fluida yang berada
dalam kesetimbangan besarnya sama ke segala arah, akan tetapi untuk zat
cair yang pekat dan dalam keadaan bergerak, variasi tekanan terhadap
kedudukan bidang datumnya merupakan suatu hal yang penting dan perlu
pembahasan khusus di luar thermodinamika. Dalam thermodinamika klasik,
umumnya diperhatikan tekanan fluida dalam keadaan setimbang.
Dalam
berbagai penggunaan, umumnya digunakan istilah tekanan absolut, yaitu
tekanan yang dimiliki oleh sistem pada batas sistem. Istilah absolut
digunakan untuk membedakannya dari tekanan relatif (pressure gauge),
karena dalam praktek, pengukur tekanan dan pegukur kevakuman menyatakan
perbedaan antara tekanan absolut dan tekanan atmosfer. Untuk memperoleh
tekanan absolut, maka tekanan atmosfer harus ditambahkan pada pembacaan
tekanan relatif, jadi :
Pabsolut = Prelatif + Patmosfer (7)
Persamaan
(7) ini digunakan untuk tekanan di atas tekanan atmosfer. Untuk tekanan
di bawah tekanan atmosfer, maka tekanan relatif menjadi negatif, dan
umumnya disebut tekanan vakum sebesar harga tekanan relatif tersebut.
Jadi tekanan relatif sebesar –10 atm disebut vakum sebesar 10 atm.
Hubungan antara tekanan absolut, tekanan relatif, tekanan atmosfer, dan
vakum dinyatakan secara grafis dalam Gambar 3 berikut ini
Gambar 3. Skema Perbandingan Tekanan
3. Hukum-Hukum Dasar Thermodinamika
Di
dalam mempelajari thermodinamika akan selalu megacu kepada hukum-hukum
dasar thermodinamika yang ada. Ada tiga hukum yang sangat penting,
yaitu hukum thermodinamika pertama, kedua dan ketiga. Ketiga hukum ini
bersama-sama dengan hukum thermodinamika ke nol membentuk suatu dasar
yang membangun pengetahuan thermodinamika. Hukum-hukum ini bukanlah
dalil (teorema) dalam pengertian dapat dibuktikan, tetapi sebenarnya
adalah postulat yang berdasarkan kenyataan eksperimental. Seperti halnya
hukum thermodinamika pertama, suatu eksperimental telah dilakukan Joule
(1840-1878) sebagai suatu perwujudan dan pembuktian dari hukum pertama
tersebut. Dalam buku thermodinamika bagian pertama ini hanya dibahas
hukum pertama dan kedua saja.
Teori Kinetik Gas
-Gas Ideal
-Gas Ideal
Gas dianggap terdiri
atas molekul-molekul gas yang disebut partikel. Teori ini tidak mengutamakan
kelakuan sebuah partikel tetapi meninjau sifat zat secara keseluruhan
menyederhanakan permasalahan teori kinetik gas diambil pengertian tentang gas
ideal, dalam hal ini gas dianggap sebagai gas ideal.
Sifat-sifat gas ideal adalah sebagai berikut.
2.Setiap partikel mempunyai masa yang sama.
3.Tidak ada gaya tarik menarik antara partikel satu dengan partikel lain.
4.Jarak antara partikel jauh lebih besar disbanding ukuran sebuah partikel.
5.Jika partikel menumbuk dinding atau partikel lain, tumbukan dianggap lenting
sempurna.
6.Hukum Newton tentang gerak berlaku.
7.Gas selalu memenuhi hukum Boyle-Gay Lussac
Seorang Inggris, Robert Boyle (1627-1691) mendapatkan bahwa jika tekanan gas
diubah tanpa mengubah suhu volume yang ditempatinya juga berubah, sedemikian
sehingga perkalian antara tekanan dan volume tetap konstan.
Hukum Boyle dirumuskan :
pV= konstan (asal suhu tidak berubah)
p1V2= p2V2
Jika ada n mol gas, persamaan untuk gas ideal menjadi p V = nRT dimana R adalah konstanta umum gas, berlaku sama untuk semua gas, nilainya R = 8,3144 joule/mol.K = 8,3144.103 Joule/Mol.K atau R = 0,0821 atm liter/mol.K (satuan sehari-hari).
Persamaan diatas menghubungkan tekanan, volume, dam suhu, yang menggambarkan
keadaan gas, maka disebut persamaan keadaaan gas atau hukum Boyle-Gay Lussac.
Perubahan variable keadaan disebut proses. Proses isotermis adalah proses yang
suhu (T) selalu tetap, maka p V = konstan. Proses isobarik adalah proses yang
tekanannya selalu konstan, V/T = konstan. Proses isokhorik/isovolume proses
yang volumenya selalu tetap p/T = konstan.Jika N adalah jumlah molekulgas dan
NA adalah bilangan Avogadro = 6,022.1023 ,maka jumlah mol gas :
n= N/NA
p V =N/N A . R. T
p V = N/N A . R. T
p V = N. R/N A . T
Karena k =R/NA == 1,3807.10-23 joule/K
disebut konstanta Boltzman disebut konstanta Boltzman (mengabadikan Ludwig Boltzman (1844-1906) dari Austria) maka, persamaan gas
Ideal menjadi : p V = N.k.T
Jumlah mol suatu gas adalah massa gas itu (m) dibagi dengan massa molekulnya. (
M = Mr )
n=m/Mr
p.V = m.R/Mr.T
Dan karena massa jenis gas (ρ=m/V ) maka kita dapatkan persamaan dalam bentuk sebagai berikut :
p=ρ.m/Mr.T
Jelas terlihat bahwa rapat gas atau massa jenis gas tergantung dari tekanan, suhu dan massa molekulnya.Persamaan gas sempurna yang lebih umum, ialah dinyatakan dengan persamaan :
p.V= n.R.T
Jadi gas dengan massa tertentu menjalani proses yang bagaimanapun perbandingan antara hasil kali tekanan dan volume dengan suhu mutlaknya adalah konstan. Jika proses berlangsung dari keadaan I ke keadaaan II maka dapat dinyatakan bahwa :
p1.V1.T1= p 2 .V2.T2
Persamaan ini sering disebut dengan Hukum Boyle-Gay Lussac.
Contoh:
1. Massa jenis nitrogen 1,25 kg/m3 pada tekanan normal. Tentukan massa jenis nitrogen pada suhu 42º C dan tekanan 0,97 105 N m-2!
Penyelesaian:
ρ1= 1,25 kg/m3
p1 = 76 cm Hg
T1 = 273 K
T2 = 315 K
p2 = 0,97 . 105 N m-2
p1 = 76 cm Hg = 76 . 13,6 . 980 dyne/cm3
= 101292,8 N m-2
(p1 V1)/T1=(p2.V2)/T2
[p1.(ρ1/m1)]T1=[p2.(ρ2/m2)]T2
101292,8/(273 . 1,25)=0,97.100.000/315ρ2
ρ2 = 0,9638 kg/m3
- See more at: http://fitriaadimustikatermodinamika.blogspot.com/2015/03/teori-kinetik-gas.html#sthash.OrG4udnP.dpuf
Teori Kinetik Gas
-Gas Ideal
-Gas Ideal
Gas dianggap terdiri
atas molekul-molekul gas yang disebut partikel. Teori ini tidak mengutamakan
kelakuan sebuah partikel tetapi meninjau sifat zat secara keseluruhan
menyederhanakan permasalahan teori kinetik gas diambil pengertian tentang gas
ideal, dalam hal ini gas dianggap sebagai gas ideal.
Sifat-sifat gas ideal adalah sebagai berikut.
2.Setiap partikel mempunyai masa yang sama.
3.Tidak ada gaya tarik menarik antara partikel satu dengan partikel lain.
4.Jarak antara partikel jauh lebih besar disbanding ukuran sebuah partikel.
5.Jika partikel menumbuk dinding atau partikel lain, tumbukan dianggap lenting
sempurna.
6.Hukum Newton tentang gerak berlaku.
7.Gas selalu memenuhi hukum Boyle-Gay Lussac
Seorang Inggris, Robert Boyle (1627-1691) mendapatkan bahwa jika tekanan gas
diubah tanpa mengubah suhu volume yang ditempatinya juga berubah, sedemikian
sehingga perkalian antara tekanan dan volume tetap konstan.
Hukum Boyle dirumuskan :
pV= konstan (asal suhu tidak berubah)
p1V2= p2V2
Jika ada n mol gas, persamaan untuk gas ideal menjadi p V = nRT dimana R adalah konstanta umum gas, berlaku sama untuk semua gas, nilainya R = 8,3144 joule/mol.K = 8,3144.103 Joule/Mol.K atau R = 0,0821 atm liter/mol.K (satuan sehari-hari).
Persamaan diatas menghubungkan tekanan, volume, dam suhu, yang menggambarkan
keadaan gas, maka disebut persamaan keadaaan gas atau hukum Boyle-Gay Lussac.
Perubahan variable keadaan disebut proses. Proses isotermis adalah proses yang
suhu (T) selalu tetap, maka p V = konstan. Proses isobarik adalah proses yang
tekanannya selalu konstan, V/T = konstan. Proses isokhorik/isovolume proses
yang volumenya selalu tetap p/T = konstan.Jika N adalah jumlah molekulgas dan
NA adalah bilangan Avogadro = 6,022.1023 ,maka jumlah mol gas :
n= N/NA
p V =N/N A . R. T
p V = N/N A . R. T
p V = N. R/N A . T
Karena k =R/NA == 1,3807.10-23 joule/K
disebut konstanta Boltzman disebut konstanta Boltzman (mengabadikan Ludwig Boltzman (1844-1906) dari Austria) maka, persamaan gas
Ideal menjadi : p V = N.k.T
Jumlah mol suatu gas adalah massa gas itu (m) dibagi dengan massa molekulnya. (
M = Mr )
n=m/Mr
p.V = m.R/Mr.T
Dan karena massa jenis gas (ρ=m/V ) maka kita dapatkan persamaan dalam bentuk sebagai berikut :
p=ρ.m/Mr.T
Jelas terlihat bahwa rapat gas atau massa jenis gas tergantung dari tekanan, suhu dan massa molekulnya.Persamaan gas sempurna yang lebih umum, ialah dinyatakan dengan persamaan :
p.V= n.R.T
Jadi gas dengan massa tertentu menjalani proses yang bagaimanapun perbandingan antara hasil kali tekanan dan volume dengan suhu mutlaknya adalah konstan. Jika proses berlangsung dari keadaan I ke keadaaan II maka dapat dinyatakan bahwa :
p1.V1.T1= p 2 .V2.T2
Persamaan ini sering disebut dengan Hukum Boyle-Gay Lussac.
Contoh:
1. Massa jenis nitrogen 1,25 kg/m3 pada tekanan normal. Tentukan massa jenis nitrogen pada suhu 42º C dan tekanan 0,97 105 N m-2!
Penyelesaian:
ρ1= 1,25 kg/m3
p1 = 76 cm Hg
T1 = 273 K
T2 = 315 K
p2 = 0,97 . 105 N m-2
p1 = 76 cm Hg = 76 . 13,6 . 980 dyne/cm3
= 101292,8 N m-2
(p1 V1)/T1=(p2.V2)/T2
[p1.(ρ1/m1)]T1=[p2.(ρ2/m2)]T2
101292,8/(273 . 1,25)=0,97.100.000/315ρ2
ρ2 = 0,9638 kg/m3
- See more at: http://fitriaadimustikatermodinamika.blogspot.com/2015/03/teori-kinetik-gas.html#sthash.OrG4udnP.dpuf
Teori Kinetik Gas
-Gas Ideal
-Gas Ideal
Gas dianggap terdiri
atas molekul-molekul gas yang disebut partikel. Teori ini tidak mengutamakan
kelakuan sebuah partikel tetapi meninjau sifat zat secara keseluruhan
menyederhanakan permasalahan teori kinetik gas diambil pengertian tentang gas
ideal, dalam hal ini gas dianggap sebagai gas ideal.
Sifat-sifat gas ideal adalah sebagai berikut.
2.Setiap partikel mempunyai masa yang sama.
3.Tidak ada gaya tarik menarik antara partikel satu dengan partikel lain.
4.Jarak antara partikel jauh lebih besar disbanding ukuran sebuah partikel.
5.Jika partikel menumbuk dinding atau partikel lain, tumbukan dianggap lenting
sempurna.
6.Hukum Newton tentang gerak berlaku.
7.Gas selalu memenuhi hukum Boyle-Gay Lussac
Seorang Inggris, Robert Boyle (1627-1691) mendapatkan bahwa jika tekanan gas
diubah tanpa mengubah suhu volume yang ditempatinya juga berubah, sedemikian
sehingga perkalian antara tekanan dan volume tetap konstan.
Hukum Boyle dirumuskan :
pV= konstan (asal suhu tidak berubah)
p1V2= p2V2
Jika ada n mol gas, persamaan untuk gas ideal menjadi p V = nRT dimana R adalah konstanta umum gas, berlaku sama untuk semua gas, nilainya R = 8,3144 joule/mol.K = 8,3144.103 Joule/Mol.K atau R = 0,0821 atm liter/mol.K (satuan sehari-hari).
Persamaan diatas menghubungkan tekanan, volume, dam suhu, yang menggambarkan
keadaan gas, maka disebut persamaan keadaaan gas atau hukum Boyle-Gay Lussac.
Perubahan variable keadaan disebut proses. Proses isotermis adalah proses yang
suhu (T) selalu tetap, maka p V = konstan. Proses isobarik adalah proses yang
tekanannya selalu konstan, V/T = konstan. Proses isokhorik/isovolume proses
yang volumenya selalu tetap p/T = konstan.Jika N adalah jumlah molekulgas dan
NA adalah bilangan Avogadro = 6,022.1023 ,maka jumlah mol gas :
n= N/NA
p V =N/N A . R. T
p V = N/N A . R. T
p V = N. R/N A . T
Karena k =R/NA == 1,3807.10-23 joule/K
disebut konstanta Boltzman disebut konstanta Boltzman (mengabadikan Ludwig Boltzman (1844-1906) dari Austria) maka, persamaan gas
Ideal menjadi : p V = N.k.T
Jumlah mol suatu gas adalah massa gas itu (m) dibagi dengan massa molekulnya. (
M = Mr )
n=m/Mr
p.V = m.R/Mr.T
Dan karena massa jenis gas (ρ=m/V ) maka kita dapatkan persamaan dalam bentuk sebagai berikut :
p=ρ.m/Mr.T
Jelas terlihat bahwa rapat gas atau massa jenis gas tergantung dari tekanan, suhu dan massa molekulnya.Persamaan gas sempurna yang lebih umum, ialah dinyatakan dengan persamaan :
p.V= n.R.T
Jadi gas dengan massa tertentu menjalani proses yang bagaimanapun perbandingan antara hasil kali tekanan dan volume dengan suhu mutlaknya adalah konstan. Jika proses berlangsung dari keadaan I ke keadaaan II maka dapat dinyatakan bahwa :
p1.V1.T1= p 2 .V2.T2
Persamaan ini sering disebut dengan Hukum Boyle-Gay Lussac.
Contoh:
1. Massa jenis nitrogen 1,25 kg/m3 pada tekanan normal. Tentukan massa jenis nitrogen pada suhu 42º C dan tekanan 0,97 105 N m-2!
Penyelesaian:
ρ1= 1,25 kg/m3
p1 = 76 cm Hg
T1 = 273 K
T2 = 315 K
p2 = 0,97 . 105 N m-2
p1 = 76 cm Hg = 76 . 13,6 . 980 dyne/cm3
= 101292,8 N m-2
(p1 V1)/T1=(p2.V2)/T2
[p1.(ρ1/m1)]T1=[p2.(ρ2/m2)]T2
101292,8/(273 . 1,25)=0,97.100.000/315ρ2
ρ2 = 0,9638 kg/m3
- See more at: http://fitriaadimustikatermodinamika.blogspot.com/2015/03/teori-kinetik-gas.html#sthash.OrG4udnP.dpuf
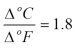
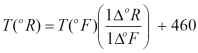

Tidak ada komentar:
Posting Komentar