Teori kinetik gas membahas
hubungan antara besaran-besaran yang menentukan keadaan suatu gas. Jika
gas yang diamati berada di dalam ruangan tertutup, besaran-besaran yang
menentukan keadaan gas tersebut adalah volume (V), tekanan (p), dan suhu
gas (T). Menurut proses atau perlakuan yang diberikan pada gas,
terdapat tiga jenis proses, yaitu isotermal, isobarik, dan isokhorik.
Pembahasan mengenai setiap proses gas tersebut dapat Anda pelajari dalam
uraian berikut.
a. Hukum Boyle
Perhatikanlah Gambar 1. berikut.
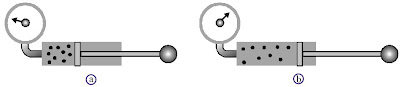 |
| Gambar 1. (a) Gas di dalam tabung memiliki volume V1 dan tekanan P1. (b) Volume gas di dalam tabung diperbesar menjadi V2 sehingga tekanannya P2 menjadi lebih kecil. |
Suatu gas yang berada di dalam
tabung dengan tutup yang dapat diturunkan atau dinaikkan, sedang diukur
tekanannya. Dari gambar tersebut dapat Anda lihat bahwa saat tuas tutup
tabung ditekan, volume gas akan mengecil dan mengakibatkan tekanan gas
yang terukur oleh alat pengukur menjadi membesar. Hubungan antara
tekanan (p) dan volume (V) suatu gas yang berada di ruang tertutup ini
diteliti oleh Robert Boyle.
Saat melakukan percobaan tentang
hubungan antara tekanan dan volume gas dalam suatu ruang tertutup,
Robert Boyle menjaga agar tidak terjadi perubahan temperatur pada gas
(isotermal). Dari data hasil pengamatannya, Boyle mendapatkan bahwa
hasil kali antara tekanan (p) dan volume (V) gas pada suhu tetap adalah
konstan. Hasil pengamatan Boyle tersebut kemudian dikenal sebagai Hukum
Boyle yang secara matematis dinyatakan dengan persamaan :
pV = konstan (1–1)
atau
p1V1 = p2V2 (1–2)
Dalam bentuk grafik, hubungan antara tekanan (p) dan volume (V) dapat dilihat pada Gambar 2.
 |
| Gambar 2. Grafik p-V suatu gas pada dua suhu yang berbeda, di mana T1>T2. |
b. Hukum Gay-Lussac
Gay-Lussac, seorang ilmuwan asal
Prancis, meneliti hubungan antara volume gas (V) dan temperatur (T) gas
pada tekanan tetap (isobarik). Perhatikanlah Gambar 3.
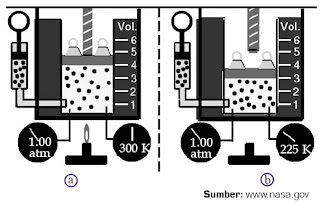 |
| Gambar 3. Pada tekanan 1 atm, (a) gas bervolume 4 m3 memiliki temperatur 300 K, sedangkan (b) gas bervolume 3 m3 memiliki temperatur 225 K. |
Misalnya, Anda memasukkan gas
ideal ke dalam tabung yang memiliki tutup piston di atasnya. Pada
keadaan awal, gas tersebut memiliki volume 4 m3 dan temperatur 300 K.
Jika kemudian pemanas gas
tersebut dimatikan dan gas didinginkan hingga mencapai temperatur 225 K,
volume gas itu menurun hingga 3 m3.
Jika Anda membuat perbandingan antara volume terhadap suhu pada kedua
keadaan gas tersebut (V/T) , Anda akan mendapatkan suatu nilai konstan
(4/300 = 3/225 = 0,013).
Berdasarkan hasil penelitiannya
mengenai hubungan antara volume dan temperatur gas pada tekanan tetap,
Gay-Lussac menyatakan Hukum Gay-Lussac, yaitu hasil bagi antara volume
(V) dengan temperatur (T) gas pada tekanan tetap adalah konstan.
Persamaan matematisnya dituliskan sebagai berikut.
 |
| Gambar 4. Grafik hubungan V–T. |
V/T = Konstan (1–3)
atau
V1/T1 = V2/T2 (1–4)
Tidak ada komentar:
Posting Komentar